Pomozite razvoju web mjesta, dijelite članak s prijateljima!
Što je unutra? Svi su sebi postavljali ovo pitanje. Ovo je jedna od karakteristika prirodne ljudske znatiželje.
Ovu radoznalost zadovoljavamo od djetinjstva. Što si duže možemo postavljati ovo pitanje (i druga slična), po mogućnosti do starosti, to će nam život biti bogatiji.
Ali što zapravo tražimo? Dijete, gledajući unutar igračke, prije svega traži neku novu strukturu materijala. Mlad čovjek, gledajući u knjigu ili internet, prije svega traži informaciju - manje ga zanima od čega je ona napravljena.Arheolog koji ispituje tek iskopanu povijesnu zgradu traži i informacije i materijalnu strukturu - potonja će također biti pretvorena u informaciju. Na isti način, geolog, gledajući (čekićem i dlijetom, povećalom, rendgenskim zrakama) u dubinu stijene, tamo traži minerale i simetriju i ljepotu.
Je li potrebno promijeniti vanjsku strukturu ili čak uništiti ono što želimo vidjeti unutra? Srećom ne! Uostalom, liječnik gleda unutar ljudskog tijela uz pomoć cijelog arsenala alata i alata. Suvremenu medicinu cijenimo zbog minimalno invazivnog ili gotovo neinvazivnog prodora. Nije potrebno gledati unutra uz pomoć ljudskih osjetila - možemo vidjeti ultrazvukom, rendgenskim zrakama, radio valovima i mnogim drugim metodama.
Jesmo li uvijek spremni na činjenicu da moramo pogledati unutra? Naravno da ne, razmislite o, na primjer, gledanju u ustajalo jaje. Alkemičari su svoje mješavine često smatrali vatrom - ponekad je eksplodirala, jer je unutra, osim strukture i informacija, bila pohranjena energija.Pogled unutar atomske jezgre čak je omogućio predviđanje, iako ne odmah, da će "iz nje biti energije."
Teorija - koncizno i jasno
Krajem prvog desetljeća 20. stoljeća, Ernst Rutherford, zajedno sa svojim kolegama Hansom Geigerom i Ernestom Marsdenom, pogledao je unutar atoma. Predmet čije postojanje stoljeće ranije nije bilo ništa više od hipoteze, zanimljivosti naslijeđene od Demokrita i nekih drugih antičkih mislilaca. Predmet za koji se još sredinom 19. stoljeća smatralo da unutra nema ništa. Objekt koji je na kraju postao toliko malen da se nije mogao vidjeti - znalo se samo da atomi zapravo postoje. Kako su izgledali unutar atoma? Što su tražili? Što su vidjeli? Je li bilo ono što su očekivali ili nešto sasvim drugačije? Definitivno vrijedi pročitati o svemu ovome
 Riža. 1. (Slijeva na desno) Ernest Rutherford, Hans Geiger i Ernest Marsden dizajnirali su i proveli niz eksperimenata između 1908. i 1911. u kojima su proučavali distribuciju materije unutar atoma. Nakon interpretacije rezultata razvili su planetarni model atoma.
Riža. 1. (Slijeva na desno) Ernest Rutherford, Hans Geiger i Ernest Marsden dizajnirali su i proveli niz eksperimenata između 1908. i 1911. u kojima su proučavali distribuciju materije unutar atoma. Nakon interpretacije rezultata razvili su planetarni model atoma.
Devetnaesto stoljeće donijelo je mnogo znanstvenih istraživanja na granici između kemije i fizike. To je uključivalo istraživanje problema "element protiv spoja" , kvantitativnog aspekta kemijskih reakcija, uključujući fenomen elektrolize, kao iu područjima termodinamike i optike. Pojavio se koncept Avogadrovog broja.
Razjašnjenje ponašanja tvari u hlapljivom stanju bio je veliki uspjeh kinetičko-molekularne teorije. Pretpostavila je zrnastu strukturu tvari, odnosno postojanje najmanjih čestica tvari: atoma ili njihovih točno definiranih skupina – molekula. Ovo je najčešće citirani primjer; mnogi drugi fenomeni također se objašnjavaju na temelju sličnih pretpostavki. S druge strane, studije materije u čvrstom stanju omogućile su procjenu veličine pojedinačnih atoma (slika 2).
Pokazalo se da su, bez obzira na element, te dimenzije bile reda veličine jednog ili dva angstrema. Također smo uspjeli procijeniti mase raznih atoma - pokazalo se da su one povezane s masenim brojem A elementa. Poznato je da su atomi električki neutralni.
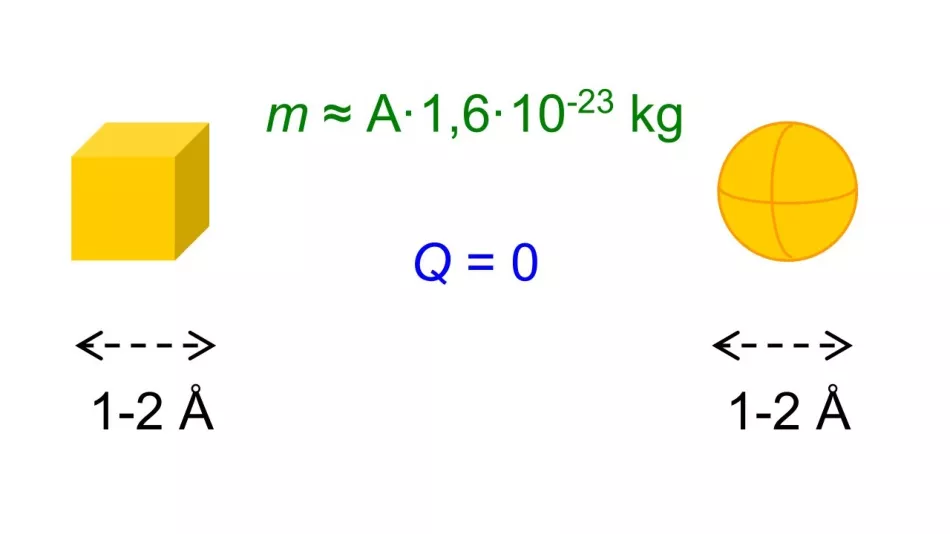 Riža. 2. Bilo da su atomi predstavljeni kao kugle, kocke ili neki drugi oblici, bile su poznate njihove približne dimenzije, atomski broj Z i maseni broj A, a bila je poznata i njihova električna inercija.
Riža. 2. Bilo da su atomi predstavljeni kao kugle, kocke ili neki drugi oblici, bile su poznate njihove približne dimenzije, atomski broj Z i maseni broj A, a bila je poznata i njihova električna inercija.
Što je unutar atoma?
Neočekivani rezultat ovog istraživanja bilo je otkriće unutarnje strukture atoma. Katodne zrake, poznate nekoliko desetljeća, prepoznate su u prvom desetljeću 20. stoljeća kao snopovi "atoma elektriciteta" (danas znamo: elektrona) sa svojstvima neovisnim o materijalu iz kojeg se emitiraju. Zaključak može biti samo jedan: elektroni su dio svakog atoma. Međutim, i njihov električni naboj različit od nule (danas znamo da je negativan) i njihova tada poznata masa (tri do četiri reda veličine manja od mase atoma) pokazuju da atomi ipak moraju imati neke komponente (Slika 3).
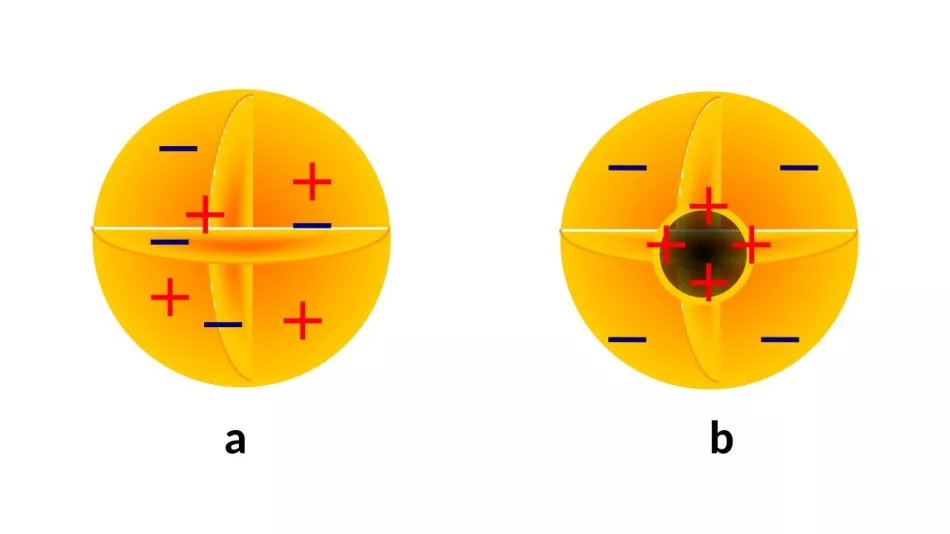 Na prijelazu u 20. stoljeće razvijeno je nekoliko modela za opisivanje prostorne raspodjele tvari i naboja. Neki (Sl. 2a) su predviđali jednoliku raspodjelu materije i naboja unutar atoma.
Na prijelazu u 20. stoljeće razvijeno je nekoliko modela za opisivanje prostorne raspodjele tvari i naboja. Neki (Sl. 2a) su predviđali jednoliku raspodjelu materije i naboja unutar atoma.Međutim, prevladavajuće je mišljenje bilo postojanje atomske jezgre (Sl. 2b) - pozitivno nabijene, masivne unutarnje podstrukture, s koji su elektroni povezani na ovaj ili onaj način, ne nužno simetrično.
Problem je bio u tome kako su komponente raspoređene unutar atoma, uključujući prirodu njihovog mogućeg kretanja. Iznesene su razne hipoteze, iako je dominantno stajalište bilo sljedeće:
- masa atoma povezana je s onim što je pozitivno nabijeno u njemu (Rutherford je to nazvao atomska jezgra);
- ova masa je više-manje ravnomjerno raspoređena po području čija je veličina manja od veličine atoma za red veličine, možda dva, tj. od 0,01Å do 0,1Å;
- U atomu ne smije biti praznog prostora, inače se atomska materija ne opire kretanju - snop elektrona, poput snopa X-zraka, slobodno prolazi kroz prilično tanka područja materije, na primjer, kroz metalne folije nekoliko mikrona debljine.
Kako pogledati unutar atoma?
Svaki današnji fizičar će vam reći da je lako. Sve što je potrebno je usmjeriti odgovarajuće čestice na atom, koje djeluju kao naboji, i proučavati učinke međudjelovanja tih naboja sa sastojcima atoma. Da bi se izbjegao učinak interakcije s elektronima, naboji moraju imati masu puno veću od mase elektrona. Ali također moraju imati masu manju od mase onoga što želimo proučavati u atomu.
Da bi se izbjegao nestabilan rezultat, naboji također moraju imati dovoljno visoku energiju. U Rutherfordovo vrijeme nije bilo akceleratora, pa je izbor naboja bio malen: α čestice, koje je otkrio deset godina ranije, prilično dobro odgovaraju tim uvjetima. Meta (fizičari ponekad koriste izraz "ekran" ) za α-čestice bili su atomi zlata u tankoj foliji. Rutherford i njegovi kolege proučavali su druge metale, ali zlato, kovan i duktilan metal, omogućilo je stvaranje filma debljine do pola mikrometra (0,510-6 m).
Mjereni učinak interakcije s atomom zlata bio je kut raspršenja čestica α (Sl. 3.).
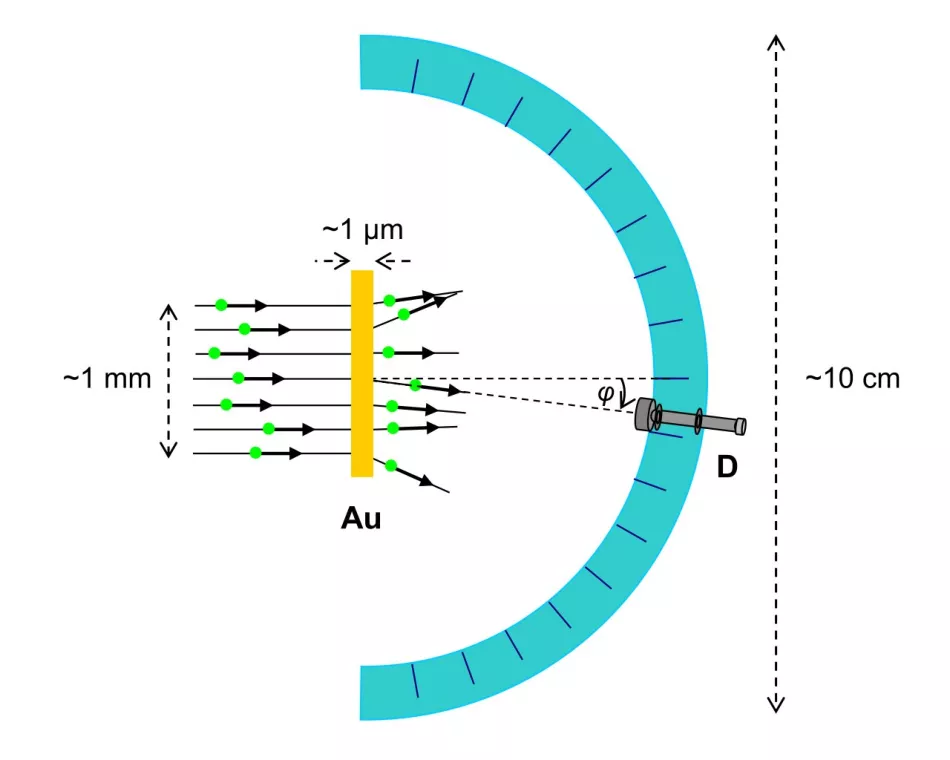 Riža. 3. Shema Rutherfordovog eksperimenta (pogled odozgo)
Riža. 3. Shema Rutherfordovog eksperimenta (pogled odozgo)
α-čestice stižu u obliku snopa širokog oko milimetra i raspršuju se u metalnoj foliji debljine oko mikrona. Detektor α-čestica nalazi se u nizu, pod različitim kutovima u odnosu na početni smjer snopa, na polukružnoj vodilici veličine oko decimetara.
Eksperimentator gleda u okular i broji bljeskove uzrokovane α česticama raspršenim pod određenim kutom unutar određenog vremena. Referentno vrijeme je isto za sve kutove.
Kut raspršenja ovisi o nekoliko faktora:
- za kinetičku energiju Ek čestice α,
- na svom punjenju, qa=+2e,
- na naboju jezgre (zlato ili bilo koji drugi element korišten u eksperimentu), tj. iz atomskog broja Z ovog elementa: Q=+Ze,
- iz procijenjenog polumjera atomske jezgre Rj,
- na udarni parametar b čestice α s jezgrom.
Što se očekivalo?
Rutherford i suradnici proučavali su koliko često dolazi do raspršenja pod određenim kutom φ u odnosu na izvorni smjer leta. U skladu s tadašnjim predodžbama o veličini atomske jezgre, očekivali su da će ti kutovi biti u ograničenom, relativno malom rasponu. Maksimalna vrijednost φmkuta raspršenja ovisi o procijenjenom polumjeru rji postiže se za svaku njegovu vrijednost pri različitim vrijednostima udarnog parametra bmSlika 4 prikazuje trag alfa čestice od 1 MeV raspršene pod najvećim kutom, uz pretpostavku da je Rj=0,01 Å. Dogodilo se da α-čestica tada prolazi kroz mali sloj jezgre.
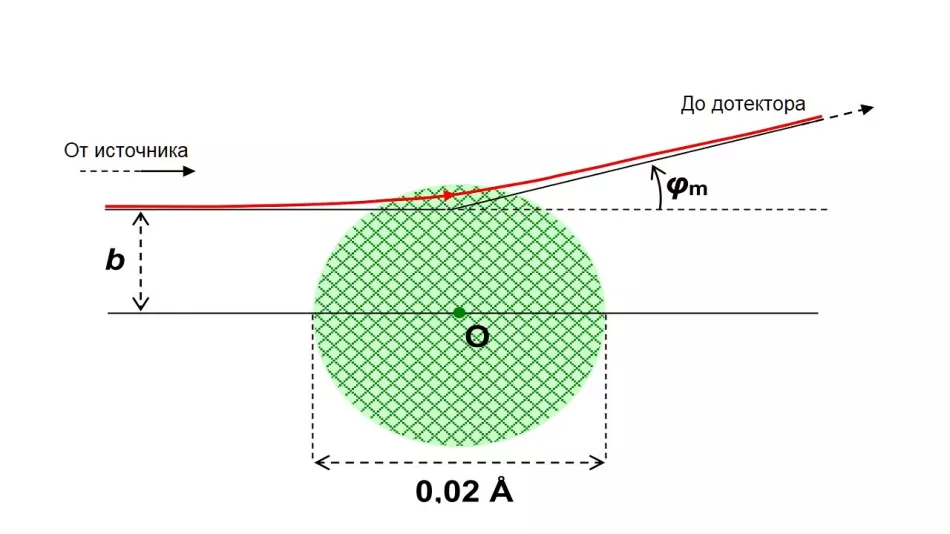 Riža. 4. Trag α-čestice s Ek=1 MeV, raspršene nakon interakcije s jezgrom atoma zlata.
Riža. 4. Trag α-čestice s Ek=1 MeV, raspršene nakon interakcije s jezgrom atoma zlata.
Usvojen je hipotetski polumjer jezgre Rj=0,01 Å (10-12 m). To je više od dva reda veličine veće od stvarnog polumjera jezgre atoma zlata. Na ovoj slici bit će manji od točke koja označava središte atoma.
Parametar viziranja b ≈ 8-10-13m osigurava maksimalni kut raspršenja φm ≈ 15°.
α čestice koje padaju s parametrima većim od bmi zaobilazeći hipotetsku jezgru uvijek se raspršuju pod manjim kutom - lete dalje od središta pozitivnog naboja i manje odstupaju. Isto vrijedi i za čestice koje padaju bliže središnjem smjeru (b
Rezultati izračuna kutova φmza nekoliko vrijednosti radijusa atomske jezgre, izvedeni u skladu sa spoznajama o strukturi atoma s početka 20. stoljeća prikazani su u tablici 1.Vrijedno je podsjetiti da Rj vrijednosti manje od 0,01 Å za atomsku jezgru u to vrijeme nisu uzete u obzir.
| Radijus atomske jezgre Rj | Maksimalni kut snopa φm | Maksimalni kut s parametrom ciljanja |
| 0.1 Å | 1,4° | 0,09 Å |
| 0,05 Å | 2,7° | 0,046 Å |
| 0,01 Å | 15° | 0,008 Å |
| 0,005 Å | 37° | 0.003 Å |
Zaključak: poznavanje vremena omogućilo nam je da dobijemo maksimalne kutove raspršenja od nekoliko stupnjeva.
Kognitivni šok eksperimentatora
Kao što je i očekivano, pokazalo se da je velika većina α-čestica raspršena pod malim kutovima, reda veličine nekoliko stupnjeva. Također se pokazalo - potpuno suprotno očekivanjima - da su se u nekim slučajevima α-čestice raspršile pod kutovima većim od 90° i čak reflektirale gotovo točno natrag! Geiger i Marsden su ovo više puta testirali koristeći malo drugačije eksperimentalne postavke prije nego što su to prijavili Rutherfordu. Nitko nije očekivao ovakav rezultat.
Rutherford se više puta prisjetio da je bio iznimno zadivljen ovim rezultatom. Tijekom jednog od svojih predavanja na Sveučilištu u Cambridgeu izgovorio je poznate riječi čiju dramatičnost nijedan prijevod ne može dočarati:
Bio je to najnevjerojatniji događaj koji mi se dogodio u životu. Bilo je gotovo jednako nevjerojatno kao da ispalite granatu od 15 inča na komad svilenog papira, a ona se vrati i pogodi vas.
Ernest Rutherford
Nastavak gornjeg citata otkriva: “Nakon malo razmišljanja, došao sam do zaključka da je širenje pod ovim kutom vjerojatno rezultat jednog sudara. Napravio sam odgovarajuće izračune; uvjerili su me da je moguće samo jedno objašnjenje: atom je sustav čija je praktički cijela masa koncentrirana u mikroskopskoj jezgri, pozitivno nabijenoj.”
Evo zaključka dostojnog fizičara: kada se dobro proveden eksperiment ne slaže s prijašnjim uvjerenjima ili čak utvrđenom teorijom, odbacujemo uvjerenja i prerađujemo teoriju.
Rutherfordova interpretacija
Upotrijebimo tri dijagrama prikazana na slikama 5, 6 i 7 da vidimo što je Rutherford vidio unutar atoma. U svim dijagramima α čestica s energijom od 1 MeV (što odgovara brzini od gotovo 7000 km/s) prilazi atomu centralno - parametar sudara jednak je nuli. Pretpostavljamo da je naboj jezgre atoma jednak naboju zlatne jezgre - 79 elementarnih naboja.Sila elektrostatskog odbijanja jezgre suprotna je brzini čestice α.
Pretpostavljamo da atom ostaje nepomičan i pitamo se može li Coulombova sila zaustaviti α česticu i poslati je natrag prije nego što prođe kroz središte jezgre. Ako je tako, tada će čestica α biti ubrzana Coulombovom silom i vratiti se tamo odakle je došla, a njezin kut raspršenja bit će 180°. Ako nije, onda će, s druge strane, α čestica letjeti dalje, a kut raspršenja bit će jednak nuli. Ispostavilo se da je veličina atomske jezgre ovdje presudna.
Rj=0,1 Å, tj. jezgra je 10 puta manja od atoma
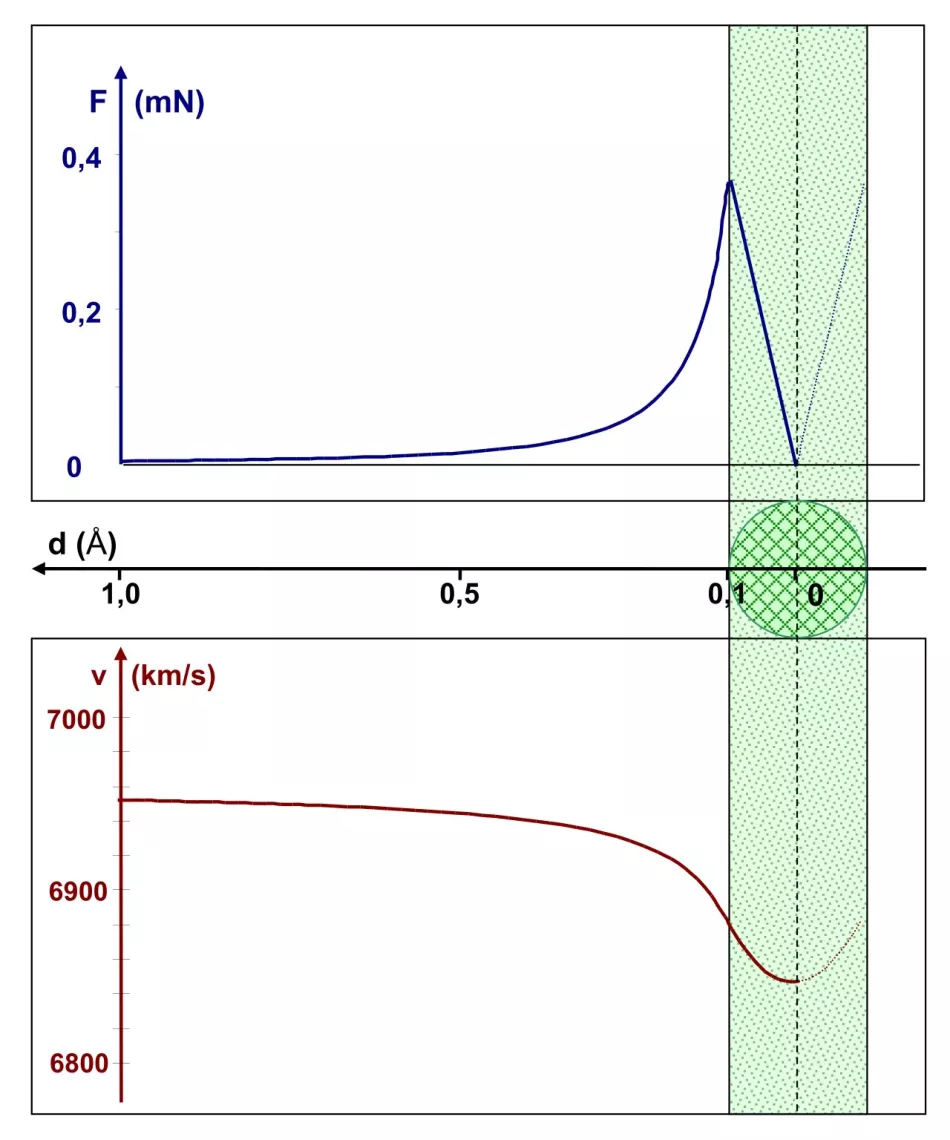
Slika 5 prikazuje situaciju u mjerilu cijelog atoma čiji je radijus 1 Å. Polumjer jezgre je Rj=0,1 Å. Gornji grafikon prikazuje ovisnost Coulombove sile o udaljenosti do središta jezgre. Ta sila doseže najveću vrijednost nešto ispod 0,4 mN kada α čestica uđe u jezgru. Počevši od ove točke, Coulombova sila linearno opada, dosežući nulu u središtu jezgre.
Ovisnost brzine čestice α o istoj udaljenosti ucrtana je na dnu dijagrama. Ova brzina opada kako se približava rubu jezgre. Nakon ulaska u područje jezgre, ovo smanjenje je manje izraženo - to odgovara smanjenju vrijednosti Coulombove sile. Sve u svemu, brzina se smanjila za manje od 2%. Nakon prolaska kroz središte jezgre, α-čestica se ubrzava, uzrokujući napuštanje jezgre, a zatim i cijelog atoma.
Zaključak: prisutnost α-čestica s energijama reda 1 MeV i više (takve su koristili Geiger i Marsden), odbijene natrag, isključuje tako veliku veličinu jezgre - reda veličine 0,1 Å.
 Riža. Slika 5. Grafički prikazi Coulombove sile i brzine čestice α kao funkcije udaljenosti d od središta atomske jezgre
Riža. Slika 5. Grafički prikazi Coulombove sile i brzine čestice α kao funkcije udaljenosti d od središta atomske jezgre
Voravna os zajednička za oba grafikona nalazi se između njih. Jezgra polumjera 0,1 Å (prikazana zelenom bojom) nalazi se na desnoj strani grafikona, tako da os udaljenosti ima neobičan zaokret: ulijevo.
Rj=0,01 Å, tj. jezgra je 100 puta manja od atoma
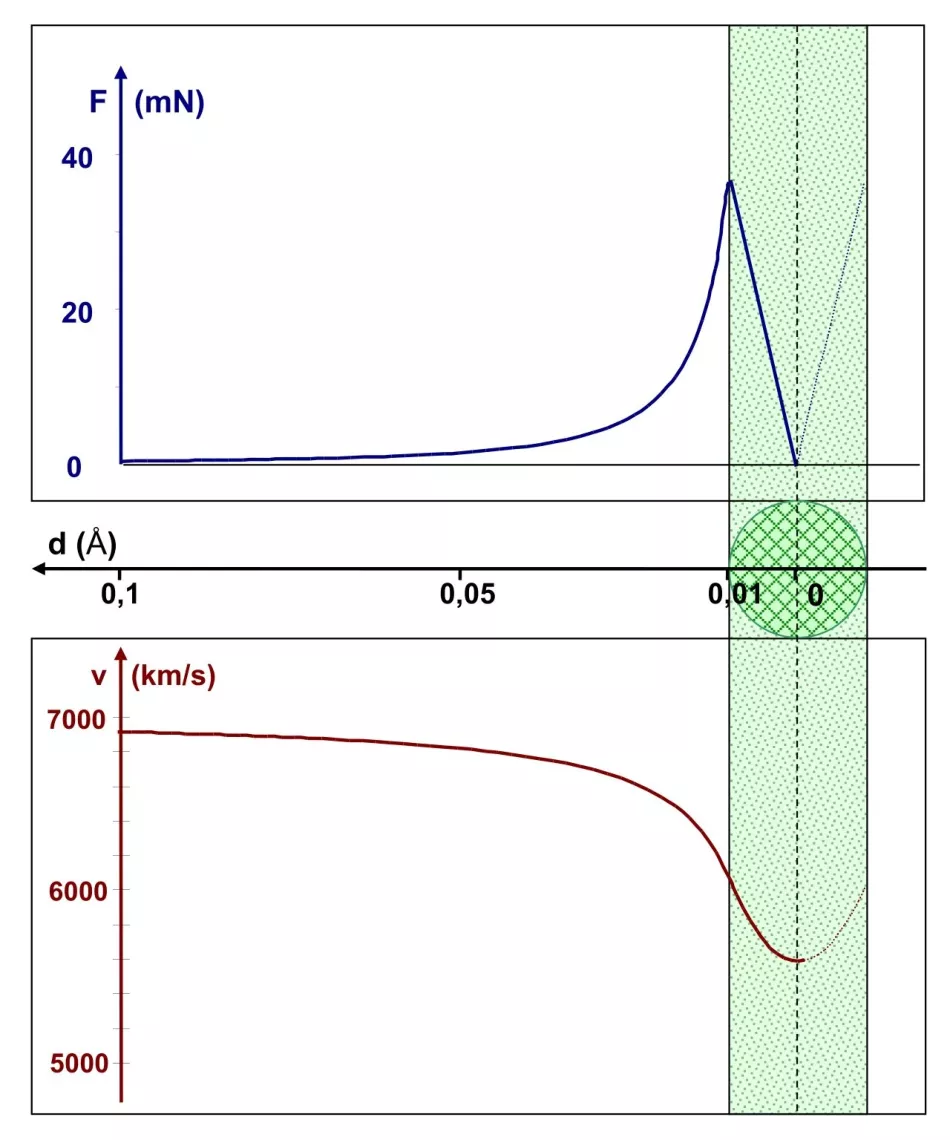
Stoga, u sljedećem krugu izračuna, smanjimo radijus jezgre deset puta, na 0,01 Å. Slika 6 prikazuje ovu situaciju, iako više ne uključuje atom čiji je približni polumjer 1 Å. Obratite pažnju na skalu na osi udaljenosti - grafikon sada pokriva područje od 0,1 Å do središta jezgre. Njegov tečaj je vrlo sličan prethodnom. Razlika je u mjerilu. Coulombova sila doseže 40 mN na rubu manje jezgre, što je sto puta više nego za veću jezgru. To je i razumljivo: omjer polumjera 1:10 znači omjer sila 100:1. To dovodi do smanjenja brzine čestica α za oko 18%. Međutim, ne smanjuje se na nulu, tako da alfa čestica prolazi kroz središte jezgre i leti kroz atom.
Zaključak: atomska jezgra mora imati radijus manji od čak 0,01 Å, inače neće reflektirati α-čestice natrag.
 Riža. Sl. 6. Grafikoni ovisnosti Coulombove sile i brzine čestice α ovisno o udaljenosti d od središta atomske jezgre polumjera 0,01 Å
Riža. Sl. 6. Grafikoni ovisnosti Coulombove sile i brzine čestice α ovisno o udaljenosti d od središta atomske jezgre polumjera 0,01 Å
Maksimalna vrijednost sile je sto puta veća nego u slučaju prikazanom na slici 5, što za sobom povlači veće smanjenje brzine čestice α.
Rj=0,001 Å, tj. jezgra je 1000 puta manja od atoma
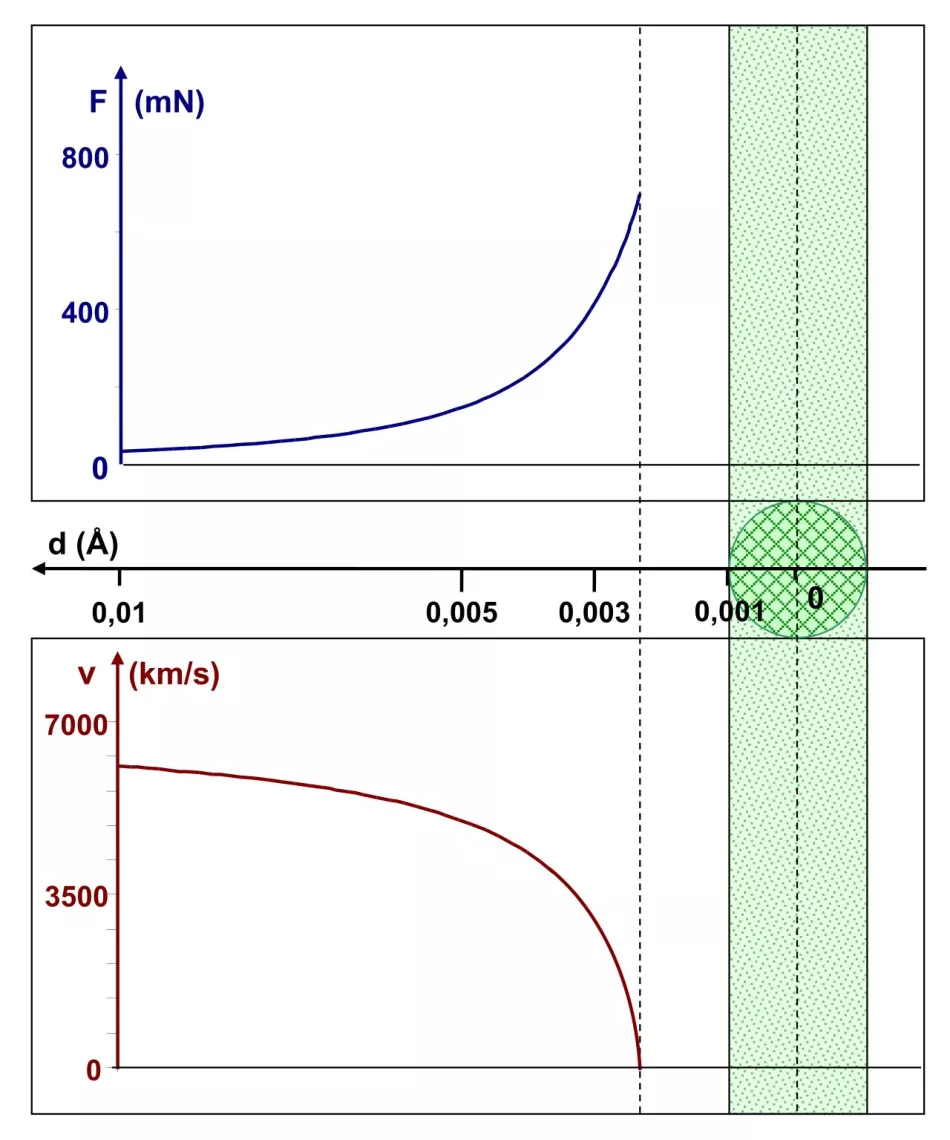
Smanjimo polumjer jezgre još jednom za deset puta - na jednu tisućinku angstroma - bez mijenjanja drugih parametara. Primjećujemo (sl. 7.) nešto novo u dijagramu brzina: njegova vrijednost pada na nulu kada je α čestica udaljena od središta jezgre oko 0,0023 Å, tj. 0,0013 Å od njegovog ruba. U tom položaju α-čestica je ubrzana u smjeru iz kojeg je došla – njezin kut raspršenja je 180°. Vrijedno je napomenuti da je Coulombova sila dosegla vrijednost od oko 700 mN.
Zaključak: atomska jezgra s polumjerom od 0,001 Å može zaustaviti α-česticu s energijom od 1 MeV i raspršiti je natrag. Postoji čak i neka "margina" za to, budući da se čestica zaustavlja malo više od 0,001 Å od ruba takve jezgre.
 Riža. Sl. 7. Grafikoni ovisnosti Coulombove sile i brzine čestice α ovisno o udaljenosti d od središta atomske jezgre polumjera 0,001 Å
Riža. Sl. 7. Grafikoni ovisnosti Coulombove sile i brzine čestice α ovisno o udaljenosti d od središta atomske jezgre polumjera 0,001 Å
Na udaljenosti od oko 0,0013 Å od ruba, alfa čestica se zaustavlja i ubrzava u smjeru iz kojeg je došla.
Zaključak
Prisutnost α-čestica s energijom od 1 MeV, raspršenih natrag, isključuje radijus atomske jezgre veći od 0,002 Å. Geiger i Marsden proizveli su alfa čestice s energijama u rasponu od preko 1 MeV do oko 5 MeV iz nekoliko različitih radioaktivnih pripravaka. Svi su bili odgurnuti. Slično razmišljanje i izračuni omogućili su Rutherfordu da odredi najveći mogući radijus atomske jezgre, koji je približno 0,001 Å.
Daljnja proučavanja strukture atoma pomoću različitih čestica, uključujući protone ubrzane u akceleratorima do sve viših energija, omogućila su proučavanje veličina jezgri raznih atoma. Pokazalo se da radijus jezgre raste s porastom njenog masenog broja A, ali ne doseže 0,0001 Å, odnosno 10-14 m.
Paralelna istraživanja atomskog sastava omogućila su, otprilike četvrt stoljeća nakon pokusa provedenih pod Rutherfordovim vodstvom, i nakon otkrića neutrona 1932. godine, određivanje sastava atomskih jezgri razni elementi i njihovi izotopi.